Артериальная гипертония
 |
 |
 |
Содержание
Артериальная гипертония это патофизиологическое и клиническое понятие, объединяющее состояния, которым сопутствует длительное повышение гидростатического давления в артериях большого круга кровообращения.
Выделяются эссенциальная артериальная гипертония (АГ, или «первичная»), причина которой до настоящего времени не установлена, и «вторичные» (симптоматические) АГ, являющиеся проявлением различных заболеваний.
Термин «артериальная гипертония» используется в документах ВОЗ. В нашей стране, как и в других странах СНГ, со времен Г. Ф. Ланга применяется термин «гипертоническая болезнь». На IV съезде кардиологов РФ принято решение отказаться от термина «гипертоническая болезнь» и заменить ею на общепринятый «артериальная гипертония» При этом имеется в виду первичное (эссенциальное) повышение артериальною давления. В качестве синонима можно использовать термин «артериальная гипертония». Артериальная гипертония самый распространенный в большинстве стран мира сердечнососудистый синдром. В США повышенное артериальное давление (140/90 мм рт. ст. при повторных измерениях) регистрируется у 30-40% взрослого населения (в возрасте старше 65 лет - у 50% населения). Эпидемиологические исследования, проведенные в России, показали, что распространенность АГ среди мужчин составляет 39, 2%. В последние два десятилетия в России и Беларуси отмечается рост смертности от основного осложнения АГ - инсульта мозга. По данным рабочей группы ВОЗ, эти страны занимают одно из первых мест в Европе по смертности от инсульта мозга.
Причины артериальной гипертонии
Этиология данного заболевания до конца не установлена. Потерпели неудачу многие унитарные гипотезы происхождения этой болезни. Полностью подтвердилось высказывание J. Page, сделанное им в 1978 г. : «современные гипотезы патогенеза эссенциальной гипертензии недолговечны и вскоре после их провозглашения подвергаются ревизии». Изучена роль различных нервных, гуморальных и других факторов в регуляции АД. В настоящее время эссенциальная гипертония рассматривается как многофакторное заболевание.
Повышение АД при АГ обусловлено сложным взаимодействием генетических, психосоциальных и физиологических механизмов. Роль наследственной предрасположенности как важного этиологического фактора АГ не вызывает сомнений. Обследование близнецов показало, что различия в уровнях АД у человека на 30-60% определяются генетическими факторами. Генетическая природа АГ нашла подтверждение и в экспериментальных исследованиях. Наибольшие успехи в расшифровке генетической предрасположенности к гипертензии были получены при изучении генотипов ренин-ангиотензинной системы. Изучаются гены эндотелин-превращающего фермента, эндотелин-А-рецептора, гены важнейших ферментов калликреин-кининовой системы и протеинов клеточных мембран. Однако имеющиеся специальные генетические данные не позволяют сегодня определить характер наследственной модели АГ. Считается, что гены программируют биосинтез ферментов по принципу: один ген один фермент. Мутация гена приводит к изменению или выпадению синтеза фермента, нарушению клеточного или тканевого метаболизма. Развивается патологический процесс по следующей схеме: ген-фермент-биохимическая реакция - клинический признак.
Однако генетическое влияние на уровень АД в значительной степени зависит от психоэмоциональных и физиологических факторов.
Существует несколько патогенетических концепций АГ. Согласно нейрогенной теории Г. Ф. Ланга, АГ рассматривается как «болезнь регуляции», развитие которой связано с длительной психической травматизацией, перенапряжением, отрицательными эмоциями. Это приводит к дисфункции регуляторов АД в гипоталамических структурах с увеличением симпатической вазоконстрикторной импульсации по эффекторным нервным волокнам и повышению сосудистого тонуса. В настоящее время в эксперименте и клинике убедительно доказаны возникновение спазма периферических артериол в ответ на эмоциональные раздражители, развитие гипертрофии клеток медии с сужением просвета сосудов и стойким повышением общего периферического сосудистого сопротивления. Однако центры–регуляторы АД не выявлены. Объемно-солевая теория А. Гайтона в качестве первопричины АГ рассматривает нарушение выделительной функции почек, которое приводит к задержке в организме Na+ и воды, а следовательно, к увеличению объема циркулирующей плазмы (ОЦП) и минутного объема крови (МОК). В ответ на повышение МОК местные механизмы саморегуляции кровотока вызывают миогенное сужение артериол и повышение общего периферического сосудистого сопротивления (ОПСС). Следствием этого является повышение АД.
В последние годы высказывается предположение, что к развитию АГ предрасположены лица с врожденной олигонефропатией (чаще бывает у новорожденных с малым весом тела).
Роль избыточного потребления соли в развитии АГ подтверждена данными эпидемиологических исследований. На основании международного исследования INTERSALT (1988) было рассчитано, что снижение потребления соли до 100 ммоль в сутки в течение жизни привело бы к снижению инсульта мозга в возрасте 55 лет на 23%.
За последние 20 лет удалось изучить значение клеточных механизмов в формировании АГ. В эксперименте и у больных с АГ показано снижение активности Na+К+АТФазы сарколеммы, которое приводит к увеличению содержания Na+ внутри клеток. Посредством Na+ Са++ обменного механизма это способствует возрастанию концентрации внутриклеточного Са++ и повышению тонуса гладкомышечных клеток артериол и венул. Нарушение функции Na+ K+ насоса является, по-видимому, генетически детерминированным, так же как увеличение Na+К+ трансмембранного обмена, что тоже приводит к повышению концентрации внутриклеточных Na+ и Са++.
Доказана несомненная роль ренин-ангиотензин-альдостероновой системы в патогенезе АГ. Высказывается предположение, что повышение АД при АГ обусловлено нарушением равновесия между ангиотензином II и оксидом азота.
Концепция гиперактивности симпатоадреналовой системы в генезе АГ вновь активно обсуждается в научных кругах. Согласно этой концепции, активация симпатоадреналовой системы приводит к гиперфункции сердца, увеличению МОК, а затем к периферической вазоконстрикции. Изучена роль агматинергической системы в развитии и стабилизации АГ. Неполноценность агматинергической системы приводит к симпатической гиперактивности, повышению АД, а также развитию метаболического синдрома. Роль метаболических нарушений в патофизиологии АГ активно изучается. Крупномасштабные исследования MRFIT и Фрамингемское показали, что АГ часто сочетается с нарушениями липидного, углеводного обмена и избыточной массой тела. N. Kaplan (1989) назвал сочетание «андроидного» ожирения, нарушения толерантности к глюкозе, гипертриглицеридемии и артериальной гипертонии «смертельным квартетом», имея ввиду неблагоприятное течение заболевания и наличие сердечнососудистых осложнений у таких пациентов. Установлено, что метаболические нарушения играют несомненную роль в становлении и прогрессировании АГ и часто предшествуют повышению АД. Пациенты, у которых гипертония сочетается с метаболическими расстройствами, представляют группу высокого риска развития осложнений. Однако с учетом того, что не все больные с АГ имеют сопутствующий метаболический синдром и не все пациенты с инсулино-резистентностью имеют повышенное АД, нельзя рассматривать АГ исключительно с позиций многофакторного нарушения обмена веществ.
В последнее десятилетие отмечается большой интерес к изучению вазорегулирующей функции эндотелия при АГ. У больных с АГ вазодилатирующий ответ периферических сосудов на ацетилхолин подавлен, что указывает на дисфунк-цию эндотелия. Такие результаты в эксперименте были продемонстрированы практически на всех моделях. В связи с этим обсуждается вопрос о возможной этиологической роли дисфункции эндотелия в развитии АГ. Интересно, что снижение ацетилхолинзависимой вазодилатации сохраняется у больных гипертонией даже в течение 5 лет регулярной гипотензивной терапии.
Однако существует альтернативная точка зрения, что повышенное АД вызывает эндотелиальную дисфункцию. В пользу этого предположения свидетельствует тот факт, что у нормальных животных, ставших за короткий срок в модели гипертониками, наблюдается снижение эндотелий-зависимого вазодилатирующего фактора. Возможно, отсутствие нормализации функции эндотелия у леченых больных объясняется тем, что вызванные гипертонией изменения необратимы при стабилизации АД.
Механизм развития артериальной гипертонии
Патогенез эндотелиальной дисфункции при гипертонии в настоящее время изучен недостаточно. Таким образом, ни одна из существующих на сегодняшний день гипотез не раскрывает полностью механизмов формирования АГ. Создается впечатление, что ближе всех к раскрытию происхождения АГ была «мозаичная теория» J. Page, в которой рассматривались тесная взаимосвязь и взаимодействие различных механизмов, регулирующих АД.
АГ - полиэтиологическое заболевание, в возникновении которого играют роль одни факторы, а в закреплении и прогрессировании - другие.
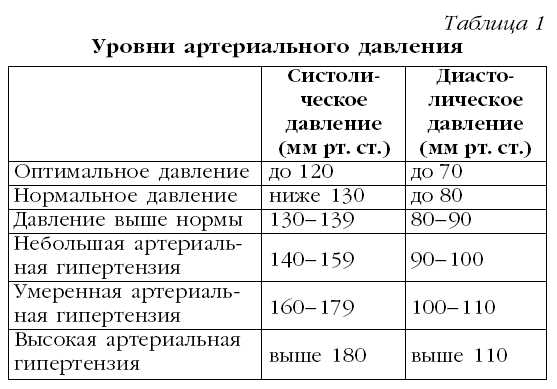
На IV съезде кардиологов РФ принята новая классификация АГ, адаптированная к работе практических врачей. Она отличается от классификации ВОЗ отсутствием группы пограничной АГ. Изменилось понятие о «нормальном» АД. В новой классификации за нормальное АД принят уровень ниже 130/85 мм рт. ст. Уровень АД 130-139/85-89 мм рт. ст. оценивается как «повышенное нормальное АД». Введение этого термина обусловлено результатами эпидемиологических исследований, в которых было показано, что риск сердечнососудистых заболеваний и летальность повышаются с увеличением уровня АД. Следует подчеркнуть, что изолированная систолическая гипертония рассматривается в рамках эссенциальной гипертензии и степень ее определяется по уровню систолического АД. Эксперты ВОЗ предлагают отказаться от терминов «мягкая», «умеренная» и «тяжелая» формы АГ и пользоваться термином «степень» (I, II, III) для обозначения тяжести течения заболевания. Причем в новой классификации критерии различных степеней тяжести АГ пересмотрены в сторону ужесточения.
За АГ принимаются состояния при уровне АД выше 140/90 мм рт. ст., определяемом как среднее значение показателя, полученного в результате не менее двух измерений во время как минимум двух последовательных визитов больного к врачу. Если больной принимает антигипертензивные препараты и их невозможно отменить, степень АГ следует завышать на одну ступень. Если систолическое и диастолическое АД соответствуют разным степеням тяжести гипертензии, уровень АД у данного человека следует относить к более высокой категории. Например, уровень АД, равный 165/95 мм рт. ст., следует расценивать как АГ II степени, а уровень АД 212/108 мм рт. ст. как АГ III степени.
В новой классификации ВОЗ/МОАГ отказались от привычного разделения АГ на три стадии в зависимости от степени поражения органов-мишеней. Теперь рекомендуется учитывать не только состояние органов-мишеней, но и другие факторы риска и клинические состояния, влияющие на прогноз. Предлагается выделить четыре степени риска развития сердечнососудистых осложнений.
Низкий риск (I степень) означает, что возможность развития сердечнососудистых осложнений в ближайшие 10 лет составляет менее 15%.
Средний риск (II степень) возможность развития осложнений в ближайшие 10 лет составляет 15-20%.
Высокий риск (III степень) 20-30% осложнений.
Очень высокий риск (IV степень) означает, что в ближайшие 10 лет риск развития осложнений превышает 30%.
Диагностика артериальной гипертонии
Выявление АГ. С учетом того, что АД может колебаться в зависимости от различных факторов и времени суток, диагноз АГ должен основываться на данных не менее двух измерений АД во время двух посещений врача. Приборы для измерения АД рекомендуется регулярно калибровать и тестировать с помощью ртутного сфигмоманометра. АД измеряется в положении пациента сидя по методике ВОЗ. Пожилым больным АД измеряется в положении сидя и стоя. АГ диагностируется, если систолическое АД больше140 мм рт. ст., диастолическое больше 90 мм. рт. ст.
В случае повышения АД I степени следует провести полную оценку спектра факторов риска и начать немедикаментозную терапию, в случае повышения АД II-III степени тактика ведения определяется врачом в соответствии с конкретной клинической ситуацией. Для исключения «гипертонии белого халата» можно оценить уровень АД в домашних условиях. Данные ряда исследований показали, что уровень АД, измеренного дома, ниже уровня, измеренного врачом. Важным фактором, влияющим на самоконтроль АД в домашних условиях, является использование стандартизованных приборов, прошедших метрологический контроль. Суточное мониторирование АД пока не является обязательным методом обследования больных с АГ.
Основные показания для СМАД: значительные колебания АД во время одного или нескольких визитов к врачу; подозрение на «гипертонию белого халата» у больных с низким риском сердечнососудистых заболеваний; АГ, рефрактерная к антигипертензивной терапии; наличие симптомов, позволяющих заподозрить возникновение эпизодов гипотонии.
Современные программы СМАД предполагают регистрацию АД каждые 15 мин в дневное время и каждые 30 мин в ночное. В настоящее время не выработана единая схема анализа суточного мониторирования АД.
Показатели суточного профиля АД: усредненные показатели систолического, диастолического, среднего, пульсового АД и ЧСС за сутки, день, ночь; максимальные и минимальные значения АД и ЧСС за различные периоды суток; «нагрузка давлением»; вариабельность систолического, диастолического, среднего и пульсового АД и ЧСС; суточный индекс (степень ночного снижения АД).
Обследование больных с АГ. Основная цель обследования больных с повышенным АД - подтвердить стабильность повышения АД, исключить вторичный характер гипертензии, оценить степень повреждения органов-мишеней, определить наличие других факторов риска и сопутствующих заболеваний, оценить индивидуальную степень риска сердечнососудистых осложнений. Обязательные исследования, которые следует про водить до начала лечения с целью выявления поражения органов-мишеней и факторов риска: анализ мочи; развернутый анализ крови; биохимический анализ крови (калий, натрий, креатинин, глюкоза, холестерин общий и липопротеидов высокой плотности); экг12; эхокардиография (для оценки гипертрофии левого желудочка, состояния систолической и диастолической функции). Специальные исследования проводятся в тех случаях, когда их результаты могут повлиять на тактику лечения данного пациента. Специальные методы исследования для установления причины повышения давления показаны в следующих случаях:
1. возраст, анамнез, результаты физического исследования и обычных лабораторных тестов, тяжесть гипертонии не исключают ее вторичный характер; достаточно быстрое нарастание ранее доброкачественно протекавшей АГ;
2. наличие кризов с выраженными вегетативными проявлениями;
3. АГ III степени и АГ, рефрактерная к медикаментозной терапии;
4. внезапное развитие АГ.
Поражение органов-мишеней при артериальной гипертонии
Поражение органов-мишеней при АГ. Основными органами-мишенями при АГ являются сердце, головной мозг, почки, сетчатка глаза и сосуды. у больных АГ гипертрофия левого желудочка (ГЛЖ) является более важным фактором риска развития сердечнососудистых осложнений, чем гиперхолестеринемия, курение и сахарный диабет. По данным Фремингемского исследования, риск смертности у мужчин увеличивается в 3,9 раза, у женщин в 4,1 раза при наличии электрокардиографических признаков гипертрофии левого желудочка. Важное значение в патогенезе гипертрофии левого желудочка играют такие факторы, как повышение уровня АД, избыточное потребление поваренной соли, повышение уровней катехоламинов, ангиотензина II, альдостерона. Электрокардиография позволяет выявить ГЛЖ у 7-8% больных, эхокардиография у 60%.
Нарушение диастолической функции рассматривается как одно из самых ранних поражений сердца при АГ. Изменение диастолической функции связывается с увеличением содержания в миокарде фиброзной ткани, коллагена и нарушением транспорта ионов кальция, что вызывает замедление релаксации и ухудшение растяжимости миокарда левого желудочка. Диастолическая дисфункция левого желудочка определяется методом допплерэхокардиографии. Известно, что у больных с АГ резерв коронарного кровотока снижается на 30-40% даже при отсутствии стеноза коронарных артерий. Данные биопсии сердца указывают на то, что ограничение резерва коронарного кровотока в большинстве случаев происходит вследствие структурных изменений мелких коронарных сосудов. Доказано, что у больных с гипертрофией левого желудочка чаше развиваются инфаркт миокарда, аритмии и сердечная недостаточность, наступает внезапная коронарная смерть. Тем не менее, к настоящему времени неизвестно, какая часть указанных осложнений возникает вследствие атеросклероза крупных коронарных артерий, миокардиального фиброза или изменений интрамуральных артерий. Поражение мозга при АГ во многом определяет прогноз заболевания. Изменения в сосудах головного мола возникают уже на ранних стадиях АГ и нарастают по мере ее прогрессирования. У пациентов, которые имеют повышенное АД с 20 лет, начальные признаки недостаточности кровоснабжения мозга могут появляться уже к 30 годам.
Начальные проявления недостаточности кровоснабжения мозга диагностируются при наличии таких церебральных жалоб, как головная боль, головокружение, шум в голове, снижение памяти и работоспособности. Для постановки диагноза начальных нарушений мозгового кровообращения необходимо наличие у больного двух или более указанных жалоб в любом сочетании. Субъективные жалобы должны отмечаться часто (еженедельно) в течение не менее 3 последних месяцев.
Г. Ф. Ланг указывал, что в начальной стадии АГ головная боль имеет не сосудистое происхождение, а является проявлением общего невроза. Эта головная боль обусловлена напряжением мягких покровов головы. Она постоянно нарастает и медленно исчезает, характерным является ощущение стягивания. Наиболее часто такая головная боль возникает на фоне психоэмоционального напряжения и стихает при релаксации.
В 1923 г. Дж. Дженуей описал типичную (как он считал) головную боль для пациентов с повышенным АД. Она возникает утром в затылочной области, сопровождается отечностью век. Эта боль вызвана гипотонией вен и затруднением венозного оттока из полости черепа.
В настоящее время доказано, что головная боль у больных АГ может быть вызвана и повышением тонуса артерий, снижением притока крови по церебральным артериям. Головная боль сопровождается потемнением в глазах, парестезиями в различных участках головы и лица. Например, ишемия вертебрально-базилярной области характеризуется слабостью мышц, главным образом в проксимальных сегментах рук, головокружением. При ишемии затылочно-височной области могут возникать различные нарушения зрения мелькание мушек, светлых звездочек, снижение остроты зрения, преходящие дефекты поля зрения. Головная боль у больных АГ может быть вызвана изменением реологических свойств крови. Замедление кровообращения при ухудшении микроциркуляции увеличивает внутричерепное кровенаполнение, если система артериовенозных анастомозов не справляется с шунтовым оттоком. Ухудшается оксигенация тканей. В таких случаях больные испытывают тяжесть в голове, упорную, диффузную головную боль, они вялы, сонливы днем и плохо спят ночью. Кожа лица у таких больных обычно багрово-цианотичная. При АГ преимущественно страдают интрацеребральные артерии диаметром 70-500 мкм и микроциркуляторное русло. Важное место среди морфологических проявлений гипертонии занимают лакунарные инфарктные полости размером 0,2-1 см, возникающие в глубоких отделах мозга. Клинически диффузные поражения белого вещества мозга проявляются интеллектуально-мнестическими нарушениями. Больные жалуются на головную боль, головокружение, шум в голове, снижение памяти и работоспособности. При этом субъективные симптомы не исчезают после отдыха.
Термин «гипертоническая энцефалопатия» был введен в 1928 г. B. S. Oppenheimer и А. М. Fishberg. По современным представлениям, под этим термином следует понимать не только диффузные повреждения мозга, но и обязательно постепенно прогрессирующее течение этого процесса. Объективным методом диагностики гипертонической энце-фалопатии является компьютерная томография мозга, при которой выявляются единичные или множественные небольшие очаги пониженной плотности белого вещества. Они располагаются в глубоких отделах полушарий: базальных ядрах, таламусе, мозжечке. Косвенными признаками энцефалопатии является расширение желудочковой системы мозга и ряда борозд полушарий большого мозга. Более чувствительный метод диагностики МРТ, при которой выявляется лейкоареоз (Ieukos-белый, araiosis-разреженный).
Поражение артериальных сосудов при АГ. Артериальные сосуды, от аорты до мельчайших резистентных артериол, испытывают при АГ перегрузки и претерпевают наиболее значимые структурно-функциональные изменения, которые появляются раньше, чем гипертрофия левого желудочка сердца или поражение почек. По современным представлениям, ключевая роль в динамике состояний сосудистой стенки, в развитии ее гипертрофии принадлежит эндотелию.
Эндотелиальный слой, пока он не нарушен, контролирует структурно-функциональное состояние интимы и медии сосудистой стенки. При длительной гипертензии, повреждениях эндотелия любой природы возникают вазоконстрикторные реакции, развивается пролиферативный процесс, нарушается биохимический гомеостаз сосудистой стенки, активируются тромбоциты. В артериях происходят структурные изменения (ремоделирование), которые приводят к сужению просвета сосуда.
Снижение податливости артериальных сосудов (или артериальный комплаенс) наблюдается у всех больных АГ. Формирование атероматозных бляшек одна из наиболее изученных форм поражения артериальных сосудов. Ультразвуковая допплерография позволяет различать атеросклеротические изменения в артериях, оценивать реакцию сосудов на фармакологические пробы. Изменения сосудов глазного дна у больных АГ имеют важное клиническое и прогностическое значение. Для оценки тяжести поражений сетчатки у больных АГ чаще используется классификация Кейта-Вегенера-Баркера:
1 стадия минимальное сегментарное или диффузное сужение артерий и артериол;
2 стадия сужение артерий и артериол, умеренное утолщение их стенок; сдавление вен артериолами, извилистость и расширение вен;
3 стадия выраженный склероз и сужение артериол, их неравномерность; крупные и мелкие кровоизлияния; экссудаты;
4 стадия те же признаки, что и при 3 стадии; двусторонний отек сосков зрительных нервов с подъемом оптического диска и смазанностью его краев; отек сетчатки, ее отслойка; яркие очажки около соска и в области желтого пятна; прогрессируюшее понижение зрения или внезапная потеря зрения на один или оба глаза.
В проспективном исследовании было показано, что 5 летняя выживаемость составляет более 80% у нелеченных больных АГ с ангиоспастической ретинопатией 1 и 2 степени и лишь 5% у больных с ретинопатией 3 и 4 степени.
Поражение почек при АГ. В основе поражения почек лежит развитие ангионефросклероза, который характеризуется снижением скорости клубочковой фильтрации. В клинической практике скорость клубочковой фильтрации определяется по клиренсу эндогенного креатинина. Повышенная скорость клубочковой фильтрации (более 130-140 мл/мин) является ранним признаком поражения - почек. Вторым показателем поражения почек является микроальбуминурия, для выявления которой используются радиоиммунные методы. Под микроальбуминурией понимается экскреция альбуминов с мочой в пределах от 30 до 300 мг за 24 ч или от 20 до 200 мкг за 1 мин. Микроальбуминурия обнаруживается примерно у 2030 % больных АГ.
Существует точка зрения, что у больных АГ микроальбуминурия имеет менее значимое прогностическое значение, чем у больных сахарным диабетом. Наличие же протеинурии (выделение белка с мочой в сутки более 300 мг) является независимым фактором смерти от сердечнососудистых осложнений у больных АГ. Существует категория больных АГ, у которых особенно выражена предрасположенность к хронической почечной недостаточности. Это больные, чувствительные к поваренной соли, с дислипидемией и страдающие сахарным диабетом. Следует отметить, что, несмотря на успехи в лечении АГ и снижение числа мозговых инсультов, гипертония остается ведущей причиной развития хронической почечной недостаточности. Например, в США за последние 20 лет число случаев терминальной почечной недостаточности, обусловленных АГ, увеличилось в 2,5 раза.
Лечение артериальной гипертонии
Принципы немедикаментозного лечения. Немедикаментозную терапию следует рекомендовать всем пациентам с повышенным АД с объяснением им необходимости изменения образа жизни. Уменьшение потребления поваренной соли с 10 до 4,5 г в сутки, как показывают рандомизированные исследования, снижает уровень АД на 46 мм рт. ст. Ограничение соли повышает эффективность лечения диуретиками и ингибиторами АПФ. Больным АГ необходимо прекратить либо уменьшить употребление алкоголя до 20-30 г чистого этанола в день для мужчин (соответствует 50-60 мл водки, 200-250 мл сухого вина, 500-600 мл пива) и менее 20 г в день для женщин. Отказ от курения предотвращает не только развитие сердечнососудистых осложнений, но и онкологических заболеваний. Уменьшение веса тела у гипертоников ведет к снижению АД и оказывает положительное влияние на другие факторы риска ИБС. Комплексная модификация диеты включает в себя увеличение употребления фруктов, овощей, продуктов, богатых калием, кальцием, морепродуктов. Следует избегать длительного потребления слишком мягкой воды (с низким содержанием солей кальция и магния). В рандомизированных исследованиях доказана роль физических нагрузок в немедикаментозном лечении АГ. Рекомендуются аэробные физические нагрузки: ходьба пешком, плавание в течении 30-45 минут 3-4 раза в неделю. Клинические исследования показали, что регулярные тренировки больных с АГ на велоэргометре 3-4 раза в неделю в течение 30 мин снижают уровень АД и позволяют уменьшить дозу антигипертензивных препаратов.
Принципы медикаментозного лечения. Основные принципы современной антигипертензивной терапии базируются на результатах крупномасштабных, рандомизированных, контролируемых исследований. Среди них необходимо отметить такие, как TOMHS, MRFIT, САРРР, HOTStudy, VACS, SYSTEYR, FACET.
Цель лечения больных АГ максимальное снижение общего риска сердечнососудистых заболеваний и летальности, которое предполагает не только снижение АД, но и коррекцию других факторов риска. Завершившиеся рандомизированные исследования не выявили преимуществ у какого-либо класса антигипертензивных препаратов в отношении степени снижения АД. В то же время, с учетом новых научных данных доказано, что уровень АД является не единственным фактором, определяющим прогноз течения АГ. Поэтому при выборе антигипертензивного препарата для начальной терапии необходимо учитывать все факторы риска, степень поражения органов-мишеней и наличие сопутствующих заболеваний.
Препарат должен не только снижать уровень АД, но и облегчать течение сопутствующего заболевания, не ухудшая качество жизни пациента. Важна доступность препарата для больного. Предпочтение следует отдавать препаратам длительного действия для достижения 24 часового эффекта при однократном и двукратном приемах. В группах больных с низким и средним риском до начала медикаментозной терапии проводится немедикаментозное лечение в течение 12 и 6 мес соответственно, контролируются уровень АД и другие факторы риска.
В группах больных с высоким и очень высоким риском наряду с немедикаментозной терапией безотлагательно назначаются антигипертензивные препараты. Для начальной монотерапии используются 6 основных классов антигипертензивных препаратов: диуретики, бета-адреноблокаторы, антагонисты кальция, ингибиторы ангиотензинпреврашающего фермента (АПФ), блокаторы альфа-l-адренергических рецепторов и блокаторы рецепторов ангиотензина II. На основании рандомизированных исследований и клинических наблюдений определены показания и противопоказания к назначению различных классов антигипертензивных препаратов.
Диуретики являются одними из наиболее дешевых антигипертензивных средств. Исследования SHEP, STOP, MRC пока-зали, что применение диуретиков достоверно снижает число мозговых инсультов у пожилых пациентов. В то же время в исследовании САРРР было показано, что сахарный диабет развивается чаще у больных АГ, получавших тиазидные диуретики или бета-блокаторы, по сравнению с больными, лечеными каптоприлом.
В качестве препарата выбора диуретики рекомендуются пожилым пациентам, при изолированной систолической гипертензии, при сочетании АГ с сердечной недостаточностью. Оптимальная доза наиболее изученного диуретика гидрохлортиазида составляет по 12,5-25 мг 2-3 раза в неделю. При лечении диуретиками необходимо учитывать их отрицательное влияние на электролитный, липидный и углеводный обмены. Не стоит назначать эти препараты в виде монотерапии больным при сочетании АГ с сахарным диабетом, хронической почечной недостаточностью, подагрой. Доказанной метаболической нейтральностью обладает только новый препарат индапамид, который назначается в дозе 2,5 мг ежедневно (индапамид-ретард в дозе 1,5 мг ежедневно). Бета-адреноблокаторы в первую очередь следует назначать при сочетании АГ со стенокардией, при тахиаритмиях, сердечной недостаточности и после перенесенного инфаркта миокарда. В качестве возможных показаний для назначения препаратов этой группы обсуждаются диабет и беременность. Выделяются неселективные, блокирующие бета-1 и бета-2 рецепторы (пропранолол, пиндолол, надолол), и селективные, блокирующие бета-1-адренорецепторы (атенолол, метопролол), препараты.
В настоящее время учитывается не только ceлективность бета-блокаторов, но и их растворимость в воде (гидрофильность) и жирах (липофильность). Бисопролол, целипролол, пиндолол обладают гидро- и липофильными свойствами. Липофильные бета-блокаторы (пропранолол, метопролол, бетаксолол) инактивируются в печени, в связи с чем их следует осторожно назначать при заболеваниях печени.
Гидрофильные бета-блокаторы (атенолол, надолол, ацебутолол) выводятся почками, и их следует осторожно назначать при почечной недостаточности. Гидрофильные бета-блокаторы меньше проникают через гематоэнцефалический барьер и реже вызывают побочные эффекты со стороны ЦНС: бессонницу, кошмарные сновидения, депрессию. Аанализ 25 контролируемых исследований показал, что кардиопротекторным действием обладают липофильные бета-блокаторы; гидрофильные бета-блокаторы при длительном применении не предупреждают летальный исход у больных, перенесших инфаркт миокарда. На основании результатов многочисленных исследований можно сделать следующие выводы:
1) в настоящее время нет убедительных доказательств благоприятного влияния бета-блокаторов на течение АГ у женщин и пожилых мужчин;
2) кардиопротекторным действием обладают липофильные бета-блокаторы;
3) у курящих мужчин гипотензивный эффект неселективных бета-блокаторов выражен слабее.
Бета-адреноблокаторы противопоказаны при обструктивных заболеваниях легких, поражениях периферических артерий, Нарушениях сердечной проводимости и брадикардии. Антагонисты кальция являются эффективными антигипертензивными средствами. Антагонисты кальция представлены тремя видами препаратов 1 поколения (короткодействующие формы), II поколения (препараты, селективно действующие на отдельные сосудистые бассейны, пролонгированные формы) и III поколения (амлодипин).
В последние годы для длительного лечения больных АГ отдается предпочтение препаратам пролонгированного действия.
Дигидропиридины короткого действия назначаются в дозе не более 30 мг в сутки или комбинируются с бета-блокаторами. Антагонисты кальция показаны пожилым пациентам, больным со стабильной стенокардией, при поражении периферических артерий. Антагонисты кальция не обладают отрицательными метаболическими эффектами. Верапамил и дилтиазем противопоказаны при нарушениях проводимости и сердечной недостаточности. Не следует назначать дигидропиридины при нестабильной стенокардии и остром инфаркте миокарда. Следует подчеркнуть, что результаты рандомизированных исследований не подтвердили высказанное ранее предположение о том, что антагонисты кальция влияют на риск развития рака и кровотечений у больных АГ.
Блокаторы альфа-1-адренегрических рецепторов. Особенностью препаратов этой группы является их положительное влияние на липидный и углеводный обмен. Блокируя альфа-1-рецепторы в простате, эти препараты улучшают мочеотделение при аденоме простаты. Во избежание ортостатических реакций перед назначением доксазозина или празозина необходимо контролировать АД в положении пациента сидя и стоя, а дозу препаратов титровать, начиная с 1 мг в сутки. По результатам исследования ALLHAT был сделан вывод, что доксазозин может увеличивать риск развития сердечной недостаточности у больных АГ, и это необходимо учитывать при длительной терапии альфа-блокаторами.
Ингибиторы АПФ ингибируют превращение ангиотензина I в ангиотензин II в крови и тканях, тормозят распад брадикинина, стимулируют синтез вазодилатирующих простагландинов, эндотелиальных факторов, уменьшают активность симпатической нервной системы, снижают уровень альдостерона в крови. Наряду со снижением АД ингибиторы АПФ обладают органопротекторным действием. Исследования АВСО и FACET показали, что ингибиторы АПФ (ренитек и моноприл) достоверно снижают число сердечнососудистых осложнений при АГ в сочетании с сахарным диабетом II типа. Исследования, проведенные в Глазго по наблюдению за 11 тыс. пациентов с АГ в течение 16 лет, показали снижение относительного риска смертности от всех причин, и в частности от рака. Общий риск смертности у больных, получавших ингибиторы АПФ, был в 1,4 раза ниже, чем у пациентов, никогда не получавших эти препараты. Самой низкой была вероятность возникновения опухолей у больных, получавших ингибиторы АПФ в течение трех лет и более. Показаниями для первоочередного назначения ингибиторов АПФ являются сочетание АГ с сердечной недостаточностью, гипертрофией и дисфункцией левого желудочка, диабетической нефропатией, перенесенный инфаркт миокарда. Категорически противопоказаны препараты этой группы при беременности, лактации, гиперкалиемии, двустороннем стенозе почечных артерий.
Блокаторы рецепторов ангиотензина II активно изучаются в настоящее время. Основное показание к их назначению при АГ - непереносимость ингибиторов АПФ. В отличие от ингибиторов АПФ блокаторы рецепторов ангиотензина II представляют собой специфические и селективные ингибиторы ренин-ангиотензин-альдостероновой системы. Эти препараты ослабляют сердечнососудистые эффекты ангиотензина II независимо от того, как произошло его образование из ангиотензина I. Все основные cepдечно-сосудистые эффекты ангиотензина II опосредуются -рецепторами, которые находятся в легких, печени, почках, аорте, некоторых участках головного мозга. К препаратам этой группы относятся лозартан (козаар), а также ирбесартан (апровель), телмисартан (микардис), вальсартан (диован). Препараты данной группы сопоставимы по гипотензивному эффекту с бета-адреноблокаторами, антагонистами кальция и ингибиторами АПФ, однако частота побочных эффектов у блокаторов рецепторов ангиотензина II выражена в меньшей степени. Противопоказания к назначению этих препаратов такие же, как для ингибиторов АПФ.
Препараты центрального действия (клонидин, метилдопа, раувольфия) вызывают большое количество побочных эффек-тов: депрессивные состояния, сонливость, чувство заложенности в носу, язвы желудочно-кишечного тракта, ухудшают качество жизни пациента, поэтому назначать их в качестве монотерапии не рекомендуется. Менее выражены побочные действия у моксонидина, который стимулирует имидазолиновые рецепторы в ЦНС. Длительность действия препарата 24 ч. Моксонидин целесообразно применять при сочетании АГ с сахарным диабетом, ожирением, женщинам в климактерическом периоде. Метилдопа по прежнему рекомендуется назначать при гипертензии у беременных.
Целевые уровни артериального давления
В ходе исследования НОТ выявлено, что наименьшее количество сердечнососудистых осложнений было у больных АГ, у которых АД было снижено до 139/83 мм рт. ст. Вместе с тем дополнительный анализ результатов исследования НОТ показал, что целесообразность снижения АД ниже 140/90 мм рт. ст. не столь очевидна при выделении групп больных без сахарного диабета.
Уровни, до которых нужно снижать АД, по мере получения новых научных данных могут пересматриваться. Например, при сочетании АГ со стенозами мозговых сосудов чрезмерное снижение АД при лечении может привести к локальной церебральной ишемии дистальнее стеноза. У таких больных надо постепенно снижать АД на 20-25% от исходного. У пожилых больных также следует снижать АД постепенно до уровня 140/90 мм рт. ст. Продолжительность периода достижения целевого АД не менее 6-12 нед.
Влияние антигипертензивной терапии на органы-мишени
Регрессия гипертрофированного левого желудочка. С методической точки зрения правильно говорить о регрессии гипертрофии левого желудочка у конкретного больного под влиянием терапии, если масса миокарда у него уменьшилась более чем на 10% или больше чем на 10г по сравнению с исходными значениями. Контрольные эхокардиографические исследования необходимо проводить не ранее чем через 6-12 мес регулярной терапии.
В ходе исследования TOMHS (1993, 1995) не было выявлено достоверных различий между препаратами пяти основных антигипертензивных групп по их влиянию на степень обратного развития гипертрофированного левого желудочка.
Результаты исследования VACS (1993, 1997) показали, что каптоприл, гидрохлортиазид в большей степени вызывают снижение массы миокарда левого желудочка, чем атенолол, дилтиазем-ретард и празозин.
По данным исследования LIVE (998), лечение индапамидом-ретард в большей степени снижает индекс массы миокарда левого желудочка, чем лечение эналаприлом. У женшин достоверная регрессия ГЛЖ при антигипертензивной терапии наблюдается только к концу 12-го месяца непрерывной монотерапии, а у мужчин уже к концу 6-го месяца лечения. Таким образом, суммируя результаты многочисленных исследований, можно сделать вывод, что наибольшую регрессию гипертрофии левого желудочка вызывает лечение диуретиками, ингибиторами АПФ, меньшую антагонистами кальция и бета-блокаторами. Клофелин и празозин, по-видимому, не оказывают существенного влияния на регрессию левого желудочка. Требует дальнейшего изучения влияние длительной терапии доксазозином, блокаторами рецепторов ангиотензина II, агонистами имидазолиновых рецепторов на обратное развитие гипертрофии левого желудочка. Снижение риска развития нарушений мозгового кровообращения
По данным рандомизированных исследований, регулярная антигипертензивная терапия снижает риск развития мозгового инсульта примерно на 40%. В наибольшей степени такое действие оказывают бета-блокаторы и диуретики. Исследование SystEur показало, что лечение антагонистом кальция нитрендипином снижает частоту инсультов у пожилых пациентов с изолированной систолической гипертензией. Это же исследование доказало снижение частоты развития деменции при регулярной гипотензивной терапии. В последние годы появляются работы, показывающие, что ингибиторы АПФ (периндоприл, цилазаприл) способны обеспечить обратное ремоделирование резистентных сосудов. Ожидается, что рандомизированное исследование PROGRESS докажет эффективность ингибиторов АПФ в предотвращении развития повторных мозговых инсультов у больных АГ. Влияние антигипертензивных препаратов на почечную гемодинамику изучено в ходе нескольких многоцентровых исследований. На основании их результатов можно рекомендовать для длительного лечения больных АГ с повышенным риском развития почечной недостаточности ингибиторы АПФ, индапамид, антагонисты кальция (верапамил, амлодипин, дилтиазем).
Комбинированная антигипертензивная терапия
По данным исследования НОТ, монотерапия при достижении целевого уровня АД оказалась эффективной только у 31,6% больных. Известно, что у большинства больных АГ начальная доза антигипертензивного препарата должна быть меньше полной рекомендуемой дозы с тем, чтобы избежать быстрого или резкого снижения АД, приводящего к гипоперфузии жизненно важных органов. Однако приблизительно у 10% больных с выраженным повышением АД или со значительными поражениями органов-мишеней требуется назначение полной суточной дозы или сочетания двух препаратов. При монотерапии антигипертензивными средствами ситуация может развиваться по следующим вариантам:
1) адекватный эффект монотерапии при минимальных побочных явлениях. Лечение следует продолжить в прежних дозах. Такой вариант встречается примерно у 1/3 больных;
2) стабилизация АД не достигнута, и необходимо увеличить дозу препарата. Такой подход обоснован, если при назначении первой дозы не было отмечено побочных эффектов (например, при лечении ингибиторами АПФ не появился кашель, отсутствует головная боль и отеки голеней при лечении антагонистами кальция). Этот вариант встречается также у 1/3 пациентов;
3) если первоначальная доза препарата близка к вершине кривой доза-эффект, то ее увеличение может привести к разви-тию побочных действий. Это проявляется развитием гипокалиемии и гиперурикемии при назначении диуретиков или постуральной гипотензией при использовании альфа-адреноблокаторов. В таких случаях целесообразно добавить второй антигипертензивный препарат.
Не следует забывать о включении контррегуляторных механизмов, препятствующих дальнейшему снижению АД при монотерапии. Это происходит почти во всех случаях, когда препарат вызывает изменения в сложной системе регуляции АД. Так, истощение запасов натрия при лечении диуретиками приводит к стимуляции ренин-ангиотензин-альдостероновой системы, а затем к активации симпатоадреналовой системы. Блокада адренергических рецепторов сердца усиливает симпатический тонус периферических сосудов и приводит к периферической вазоконстрикции (особенно при коротком курсе лечения). Блокада ангиотензин-превращающего фермента может привести к реактивному усилению активации секреции ренина.
В связи с этим в последнее время все большее значение придается комбинированной антигипертензивной терапии, в том числе с фиксированными дозами препаратов, совмещенных водной таблетке или капсуле. Современная комбинированная терапия должна проводиться с обязательным учетом влияния препаратов на органы-мишени, метаболических эффектов и качества жизни пациентов. При комбинации препаратов разных фармакологических групп возможно более эффективно снизить АД за счет того, что происходит воздействие на различные патогенетические механизмы гипертонии.
При комбинированной терапии гипотензивный эффект удается достичь назначением антигипертензивных препаратов в низких дозах, что позволяет избежать возникновения дозозависимых неблагоприятных явлений или уменьшить степень их выраженности.
Оптимальной считается такая комбинация антигипертензивных препаратов, если:
Соблюдается принцип фармакологической совместимости, то есть лекарства не мешают друг другу;
Сохраняется фармакокинетическая совместимость комбинация не дает резких колебаний АД;
Снижается риск ИБС и других сердечнососудистых осложнений;оказывается положительное влияние на органы-мишени;
Используются минимальные дозы каждого из комбинируемых препаратов.
Эксперты ВОЗ рекомендуют следующие комбинации антигипертензивных препаратов:
Предпочтительные комбинации: диуретик + адреноблокатор, диуретик + ингибитор АПФ (или блокатор рецепторов ангиотензина II); антагонисты кальция (дигидропиридины) + адреноблокаторы; антагонисты кальция + ингибитор АПФ; альфа-адреноблокатор + адреноблокатор.
Менее предпочтительные комбинации: антагонисты кальция + диуретик; бета-адреноблокатор + ингибитор АПФ.
Для получения более подробной информации пожалуйста пройдите по ссылке
Консультация по поводу лечения методами традиционной восточной медицины (точечный массаж, мануальная терапия, иглоукалывание, фитотерапия, даосская психотерапия и другие немедикаментозные методы лечения) проводится в Центральном районе Санкт-Петербурга (7-10 минут пешком от станции метро «Владимирская/Достоевская»), с 9.00 до 21.00, без обеда и выходных.
Уже давно известно, что наилучший эффект в лечении заболеваний достигается при сочетанном использовании «западных» и «восточных» подходов. Значительно уменьшаются сроки лечения, снижается вероятность рецидива заболевания. Поскольку «восточный» подход кроме техник направленных на лечение основного заболевания большое внимание уделяет «чистке» крови, лимфы, сосудов, путей пищеварения, мыслей и др. – зачастую это даже необходимое условие.
Консультация проводится бесплатно и ни к чему Вас не обязывает. На ней крайне желательны все данные Ваших лабораторных и инструментальных методов исследования за последние 3-5 лет. Потратив всего 30-40 минут Вашего времени вы узнаете об альтернативных методах лечения, узнаете как можно повысить эффективность уже назначенной терапии, и, самое главное, о том, как можно самостоятельно бороться с болезнью. Вы, возможно, удивитесь - как все будет логично построено, а понимание сути и причин – первый шаг к успешному решению проблемы!