Восстановление после инфаркта миокарда
 |
 |
 |
Содержание
Амбулаторный этап лечения инфаркта миокарда
Больные, выписанные из стационара или санатория после перенесенного ИМ, представляют неоднородную группу по тяжести болезни, сопутствующего заболевания, переносимости лекарств, психологического состояния и социального положения. Следует отметить, что первый год после перенесенного ИМ для пациентов является самым ответственным.
Это связано прежде всего с высокой летальностью на первом году жизни пациентов, которая достигает 10% и более, что значительно больше, чем в последующие годы, а также необходимостью адаптации больных к новым условиям жизни, профессиональной деятельности, взаимопониманию в семье.
Чаще больные умирают внезапно от нарушения ритма сердца (желудочковой пароксизмальной тахикардии, фибрилляции желудочков) и повторного ИМ. Примерно 20% больных, перенесших инфаркт, в течение года поступают в стационар повторно, в связи с явлениями нестабильной стенокардии или повторного инфаркта.
После перенесенного инфаркта прогноз больного определяется в основном следующими факторами:
• степенью дисфункции левого желудочка, которая отражает размеры перенесенного инфаркта;
• наличием и стойкостью выраженности ишемии миокарда;
• наличием и стойкостью аритмий сердца.
Особенности поликлинического этапа реабилитации
• значительное изменение режима пациентов, к которому он адаптировался во время пребывания в санатории или стационаре;
• меняется уровень физической активности: прибавляются физические нагрузки, передвижение по городу, возобновляются контакты с работой;
• отсутствует ежедневная опека медицинского персонала.
Все это может отрицательно сказаться на самочувствии больного.
Для уточнения степени риска развития поздних осложнений перенесенного ИМ требуется проведение исследования состояния функциональной способности сердечнососудистой системы в целом и выявление ишемии миокарда. К ним относят: проведение ЭКГ-пробы с физической нагрузкой, стрессэхокардиография, суточное мониторирование ЭКГ и АД. Для изучения степени развития нарушений насосной функции миокарда рекомендуется исследование фракции выброса левого желудочка (ЭхоКГ).
Для оценки аритмического риска — холтеровское мониторирование ЭКГ, исследование вариабельности сердечного риска, депрессии интервала С-Т, наличие поздних потенциалов.
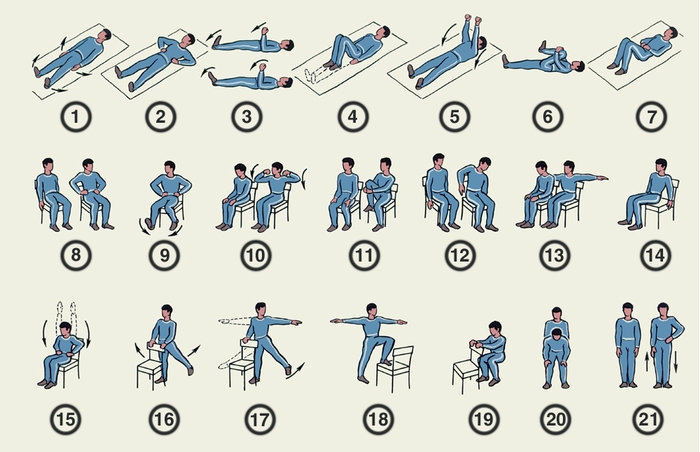
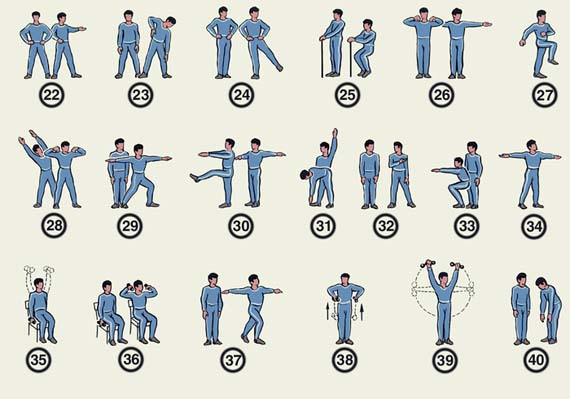
На поликлиническом этапе реабилитации особое место занимает его физический аспект. Основные цели длительных физических тренировок:
1) восстановление функции сердечнососудистой системы с помощью включения механизмов компенсации кардиального и экстракардиального характера;
2) повышение толерантности к физическим нагрузкам;
3) замедление прогрессировавши атеросклеротического процесса;
4) снижение частоты сердечных сокращений;
5) восстановление трудоспособности и возвращение к профессиональному труду;
6) улучшение психического профиля и качества жизни больного.
Физические тренировки
Регулярные физические тренировки (ФТ) уменьшают смертность на 20-25%. По интенсивности физические нагрузки должны проводиться низкие и умеренные. Другим условием является их регулярность, так как нерегулярные занятия могут привести к срыву компенсаторный возможностей сердечнососудистой системы. Используют следующие физические режимы: щадящий, щадяще-тренирующий и тренирующий.
Для выбора оптимального двигательного режима необходимо каждого больного определить к тому или иному функциональному классу по рекомендациям Канадской ассоциации кардиологов. Для этого проводится проба с физической нагрузкой на велоэргометре.
К I ФК будут относиться пациенты, у которых толерантность к физической нагрузке составляет 125 Вт и более, признаков ХСН нет;
К II ФК — ТФН 75-100 Вт, ХСН нет или не выше I степени;
К III ФК — ТФН 50 Вт, ХСН нет или III степени
К IV ФК — ТФН менее 50 Вт, ХСН нет или I-III степени.
В зависимости от ФК стенокардии подбирается и режим тренировок. Так, пациентам с I ФК показан тренирирующий режим, пациентам с II-III ФК — щадяще-тренирующгш и пациентам с IV ФК — щадящий режим.
Существуют разные методы тренировок:
1) контролируемые (проводимые в условиях лечебного учреждения)
2) неконтролируемые (проводимые в домашних условиях по индивидуальному плану).
Используют следующие виды физических тренировок: ходьбу и лечебную физкультуру. Дозированная ходьба является самым доступным и показанным видом тренировок. Она рекомендуется всем пациентам. Степень ее нагрузки регулируется в зависимости от наличия у больного ФК стенокардии.
При стенокардии I ФК темп передвижения допускается до 5—6 км/ч, при II ФК — 4 км/ч, при III ФК — 2,5-3 км/ч, пациенты с IV ФК совершают прогулки в темпе не более 2 км/ч.
Второе место по значимости физических нагрузок занимает лечебная гимнастика. Этот вид физических нагрузок лучше проводить в условиях лечебного учреждения, где формируются группы из пациентов приблизительно одного возраста и относящиеся к определенному ФК стенокардии (чаще I и II ФК), пациенты III и IV ФК занимаются по индивидуальным программам.
Больные с I ФК могут заниматься лечебной гимнастикой в тренирующем режиме по 30-40 мин ежедневно, при этом во время занятий максимальная ЧСС не должна превышать 130-140 в мин. При II ФК длительность занятий составляет до 30 мин, максимальная ЧСС не должна превышать 120130 в мин. При III ФК разрешаются занятия продолжительностью не более 20 мин, ЧСС не должна превышать 90-100 в мин.
Все физические нагрузки проводятся под контролем общего самочувствия пациента. Обязательно отмечается реакция на нагрузку (частота пульса и дыхания, показатели АД, цвет кожных покровов и слизистых оболочек, потоотделение). Инструктор по лечебной гимнастике контролирует больных перед началом занятий, во время выполнения нагрузки и в конце занятий, лечащий врач контролирует больных не реже одного раза в неделю в начале, а затем через каждые 1-2 недели занятий.
При самостоятельных занятиях пациент сам должен контролировать частоту пульса и отмечать в дневнике все изменения, возникшие во время занятий (боль в грудной клетке, аритмии, общее самочувствие и др.), и при очередном посещении врач оценивает переносимость физической нагрузки.
Критериями усвоения нагрузок и переход к следующему этапу являются физиологический тип реакции, уменьшение клинических проявлений ИБС и повышение толерантности к нагрузке (урежение ЧСС, стабилизация АД). Такие виды физических нагрузок проводятся пациентами в течение всего пребывания его на больничном листке, т.е. до выписки на работу.
Противопоказания к длительным тренировкам:
• аневризма ЛЖ с неорганизованным и организованным тромбом;
• стенокардия 3-4 ФК;
• тяжелые нарушения ритма (постоянная форма мерцательной аритмии, нарушение атриовентрикулярной проводимости выше I степени, желудочковая экстрасистолия высокой градации по Лауну);
• недостаточность кровообращения ПБ стадии (II ФК и выше);
• артериальная гипертензия со стабильно высокими цифрами диастолического АД, т.е. выше 110 мм рт. ст.;
• сопутствующие заболевания, затрудняющие проведение физических тренировок (полиартриты с нарушением функции суставов, дефекты и ампутации конечностей и др.).
При вторичной профилактике инфаркта миокарда, основными целями являются: воздействие на факторы риска ИБС, предотвращение поздних осложнений инфаркта миокарда, летального исхода, нестабильной стенокардии, нарушения ритма, а также развития ХСН.
Основные факторы риска внезапной смерти:
• повторные приступы стенокардии малой нагрузки или спонтанные;
• систолическая дисфункция левого желудочка (ФВ менее 40%);
• левожелудочковая недостаточность (одышка, быстрая утомляемость, наличие влажных хрипов в легких, рентгенологические признаки застоя);
• желудочковые аритмии — частые экстрасистолы, эпизоды желудочковой тахикардии;
• клиническая смерть в остром периоде инфаркта миокарда;
• синусовая тахикардия в покое;
• возраст старше 70 лет;
• склонность к артериальной гипотонии;
• безболевая ишемия миокарда (ЭКГ, холтеровское мониторирование);
• сахарный диабет.
Для предупреждения этих осложнений необходимо проводить следующие мероприятия:
1) коррекцию факторов риска прогрессирования атеросклероза;
2) активное лечение артериальной гипертонии и сахарного диабета;
3) лекарственную терапию перенесенного инфаркта миокарда.
Коррекция факторов риска прогрессирования атеросклероза у больных, перенесших ИМ, факторы риска атеросклероза продолжают действовать, способствуя прогрессированию заболевания и ухудшая прогноз.
Как правило, у таких больных имеет место несколько факторов риска, усиливая влияние каждого в отдельности. Поэтому коррекция факторов риска у больных после перенесенного ИМ должна быть составной частью тактики лечения.
К мероприятиям по воздействию на факторы риска относятся:
• обязательное прекращение курения;
• поддержание АД иа уровне менее 130/85 мм рт. ст.;
• соблюдение антиатеросклеротической диеты;
• нормализация веса тела;
• регулярная физическая активность.
Важное значение придается соблюдению диеты, причем, у пациентов, перенесших ИМ, пищевой рацион должен быть строже. Изменение диеты заключается в уменьшении содержания в ней продуктов животного происхождения (жирные сорта мяса, сала, сливочного масла, сметана, яйца, сыр, колбаса, сосиски), замене животных жиров растительными, увеличении употребления продуктов растительного происхождения (овощи, фрукты, орехи, бобовые) и рыбных блюд. Однако даже самая строгая диета способна снизить содержание общего холестерина всего на 10-15% и не более (см. приложение).
В амбулаторных условиях при отсутствии противопоказаний следует продолжить обязательную медикаментозную терапию: антиагреганты, статины, ингибиторы АПФ и бета-адреноблокаторы.
Статины. Независимо от показателей липидного профиля все пациенты, перенесшие ИМ, должны получать статины. Статины:
1) восстанавливают нарушенную функцию эндотелия;
2) подавляют оксидативный стресс, ведущий к модификации ЛПНП;
3) подавляют асептическое воспаление артерий;
4) подавляют выработку металлопротеаз, вызывающих деградацию фиброзной оболочки бляшки и тем самым предотвращают разрыв покрышки ее;
5) усиливают вазодилатирующие свойства венечных артерий.
Статины эффективно снижают риск обострений ИБС. Доказано, что длительный прием статинов ведет к снижению конечных точек частоты возникновения повторного инфаркта на 30%, по сравнению с этими показателями в группах лиц, не получавших статины.
Антитромболитическое лечение (аспирин, клопидогрелъ, тромбоАСС). Применение дезагрегантов предотвращает тромбообразование в коронарных сосудах, и, кроме того, они обладают противовоспалительными свойствами. Доказано, что при их применении снижается риск повторного ИМ. Дезагреганты необходимо назначать всем больным, не имеющим противопоказаний.
Доказано, что в течение ближайших нескольких лет применение дезагрегантов приводит к снижению риска сердечнососудистой смертности на 15%, а нефатального ИМ — на 34%.
Ингибиторы АПФ в лечении больных ИМ заняли свою определенную нишу. После перенесенного крупноочагового ИМ неминуемо наступает процесс ре моделирования миокарда левого желудочка, проявляющийся вначале гипертрофией оставшейся части миокарда, затем расширением (дилатацией) левого желудочка, истончением его стенок и развитием митральной недостаточности. Это приводит к изменению геометрии сердца, из эллипсовидной оно превращается в шаровидную форму, снижая тем самым экономичность его работы. В конечном итоге происходит ухудшение систолической и диастолической функции сердца, что усугубляет коронарную недостаточность и способствует развитию ХСН.
Пусковыми механизмами ремоделирования миокарда являются нейрогормональные стимуляторы: катехоламины, ангиотензин II, альдостерон, эндотелии, концентрация которых после перенесенного ИМ увеличивается в десятки раз. Под их влиянием активируется фактор роста, что сопровождается гипертрофией кардиомиоцитов. Важную роль в ремоделировании миокарда играет альдостерон, стимулирующий синтез коллагена фибробластами.
Роль ингибиторов АПФ в этом процессе выражается в ослаблении активности вазоконстрикторного звена нейрогормонов и усилении вазодилатирующего компонента, т.е. предотвращении процессов ремоделирования левого желудочка. Помимо этого они снижают пред- и постнагрузку на сердце, урежают ЧСС, увеличивают сократительную способность миокарда и сердечный выброс, улучшают диастолическое наполнение левого желудочка, предотвращают электролитный дисбаланс и улучшают функцию эндотелия.
В связи с вышеперечисленным ингибиторы АПФ показаны всем пациентам, перенесшим крупноочаговый ИМ и не имеющим противопоказания, особенно они показаны больным с обширным или передним инфарктом и сниженной сократительной способностью левого желудочка.
Бета-адреноблокаторы. Эта группа препаратов обладает целым рядом фармакологических свойств, которые делают их полезными для применения пациентами, перенесшими ИМ, а именно:
• они уменьшают потребность миокарда в кислороде;
• повышают порог возбудимости для развития фибрилляции желудочков;
• снижают активность симпатикоадреналовой системы;
• уменьшают накопление ионов кальция в сердечных клетках, снижая возбудимость миокарда;
• повышают сердечный выброс.
Реализуется это снижением общей смертности больных на 1-м году жизни после инфаркта. По данным контролируемых исследований убедительно доказано положительное влияние бета-блокаторов на снижение риска повторного ИМ, внезапную смерть и общую смертность. Поэтому в этой группе больных бета-блокаторы считаются обязательным компаонентом терапии ИБС.
Нитраты. Препараты этой группы назначаются больным с ранней постинфарктной стенокардией или с немой ишемией миокарда, диагностированной методом суточного мониторирования ЭКГ.
Преимущественно следует использовать длительно действующие нитраты, включая препараты изосорбида-5-мононитрата. При субъективной непереносимости нитратов или развитии привыкания следует использовать молсидомин в дозе 2-4 мг 23 раза в день или ее ретардную форму 8 мг 1-2 раза в сутки.
Антагонисты кальция. Кардиоселективные АК (верапамил, дилтиазем) могут назначаться при невозможности применения бета-адреноблокаторов, при вазоспастической стенокардии, без сердечной недостаточности и выраженной систолической дисфункции левого желудочка, без синдрома слабости синусового узла и нарушения проводимости сердца.
Добавление к лечению длительно действующих АК производных дигидропиридинового ряда (амлодипин, фелодипин и др.) возможно в тех случаях, когда другими средствами не удается контролировать стенокардию и АГ. Доза препаратов: для амлодипина — 5-10 мг/сут, фелодипина — 5-10 мг/сут, 1 исрадипина — 2,5—10 мг/сут, верапамила — 240-480 мг/сут, дилтиазема 180-360 мг/сут.
Триметазидин. Препарат обладает антиангинальным действием, при отсутствии, что очень важно, влияния на гемодинамику. Лучше использовать пролонгированную форму препарата (триметазидин МФ) в дозе 35 мг 2 раза в день на любом этапе терапии для усиления антиангинальной эффективности других препаратов. Его можно использовать длительно, в течение 2-3 месс повторными курсами лечения.
Коррекция психических нарушений после инфаркта
На протяжении всех этапов восстановительного периода необходимо уделять внимание психической реабилитации. Нарушение психики, проявляемое в виде депрессии, встречается у 82% больных, перенесших ИМ, что существенно затрудняет процессы восстановления. Из них 25% нуждаются в психологической коррекции тревоги, 34% — в уменьшении депрессии, 8% — в коррекции реакции отрицания болезни. По ; данным исследования, проведенного Государственным научно-исследовательским центром профилактической медицины, у больных ИБС «большая» депрессия встречается у 20% больных. Особенно часто (около 30%) она наблюдается после перенесенного обширного инфаркта и операции АКШ.
Исследования последних лет свидетельствуют о том, что депрессия является мощным независимым предиктором смертности у больных с установленной ИБС. Уровень смертности среди больных, перенесших ИМ и страдающих депрессией» в 3-6 раз выше, чем среди таких же больных, но не имеющих признаков депрессии. Важно отметить, что негативное влияние на прогноз оказывает не только «большая», но и маловыраженная депрессивная симптоматика. Выявлена взаимосвязь нарушения психики не только с кардиальными, но и с мозговыми катастрофами.
Какие существуют патофизиологические механизмы взаимосвязи депрессии с прогрессированием болезни?
Во-первых, она предрасполагает к повышенной вазоконстрикции, способствует агрегации тромбоцитов и тромбообразованию.
Во-вторых, активируется гипоталамо-гипофизарно-надпочечниковая система с усилением выработки гормона коры надпочечников, что может привести к инсулинорезистентности, гиперпродукции стероидов, повышению риска сердечно-сосудистых осложнений.
И, в-третьих, у больных с депрессией и тревожной симптоматикой нарушена эндотелиальная функция, которая играет ключевую роль в прогрессировании атеросклероза и ИБС. При тревожно-депрессивных расстройствах отмечается гиперактивность симпатикоадреналовой системы, повышенный уровень в крови катехоламинов, что способствует повышению АД.
Вольные после ИМ при наличии депрессии чаще жалуются на приступы стенокардии, ограничения физической активности и менее удовлетворены результатами лечения по сравнению с больными без депрессии. У них достоверно ниже толерантность к физической нагрузке. Кроме того, у больных с депрессией значительно снижена приверженность к лечению и соблюдению врачебных рекомендаций.
Пациенты нерегулярно принимают рекомендованные препараты, реже придерживаются здорового образа жизни, не соблюдают нужную диету, продолжают курить, неохотно участвуют в мероприятиях по реабилитации и вторичной профилактике.
Установлено, что частота развития новых случаев инфаркта в течение 5 лет выше среди лиц с повышенными показателями депрессивности.
Диагностика. Следует сказать, что депрессивные состояния в большинстве случаев не выявляются и соответственно не лечатся. Это связано с недостаточной информированностью кардиологов о современных возможностях диагностики и терапии депрессии. Кроме того, у больных после ИМ чаще наблюдаются скрытые, маскированные депрессии. Пациенты могут даже не предъявлять собственно депрессивных жалоб. В клинической картине маскированной депрессии преобладает соматическая и вегетативная симптоматика. Чаще всего масками «малой» депрессии являются различные нарушения сна (трудности засыпания, раннее пробуждение или повышенная сонливость), нарушение аппетита (повышение или понижение), изменение массы тела, повышенная утомляемость или раздражительность, снижение физической активности, имеет место болевой синдром разной локализации (кардиалгия, головные боли, боли в спине). Все это сопровождается вегетативными расстройствами в виде приступов сердцебиения, одышки, головокружения, а также различными нарушениями в сексуальной сфере. В других случаях преобладают симптомы тревоги: беспокойство, ожидание худшего, эмоциональная лабильность, раздражительность, постоянный страх «за сердце» и состояние здоровья в целом. Следует отметить, что многие симптомы депрессии являются общими с основным заболеванием и иногда их бывает трудно различить.
Выделяют девять диагностических критериев депрессии:
• Подавленное настроение (на протяжении большей части дня).
• Снижение интересов или чувства удовольствия.
• Значительное снижение или повышение аппетита и массы тела.
• Нарушение сна (бессонница или сонливость).
• Психомоторное возбуждение или заторможенность.
• Повышенная утомляемость, упадок сил.
• Ощущение собственной бесполезности или чувства вины.
• Снижение способности к концентрации внимания, принятию решений.
• Повторяющиеся мысли о смерти, суицидальные попытки.
«Большую» депрессию диагностируют при наличии у больного на протяжении 2 нед и более минимум 5 критериев, причем присутствие первых двух является обязательным. Врачи чаще сталкиваются с «малой» депрессией. Для постановки диагноза «малой» депрессии достаточно наличия у больного подавленного настроения или утраты интересов на протяжении 2 нед и более и еще любых двух критериев из числа приведенных.
Различают следующие виды психических нарушений: тревожно-депрессивный синдром (встречается у 52% больных); кардиофобический и депрессивно-ипохондрический синдромы — по 12% каждого.
Для тревожно-депрессивного синдрома характерно изменение поведения пациента в виде подавленности настроения, апатии, безнадежности и пессимистической оценки болезни в перспективе. Больные, как правило, постоянно тревожны и взволнованны. На лице у них выражение печали, тревоги и слезливость. Речь тихая и замедленная.
Кардиофобическии синдром характеризуется чрезмерным страхом смерти, страхом за свое сердце, боязнь любых физических нагрузок, что накладывает определенный отпечаток на поведение больного. Пациент боится один далеко уходить от дома.
Нередко развиваются приступы кардиофобических реакций, проявляющиеся бледностью кожных покровов, потливостью, сердцебиением, ощущением нехватки воздуха, дрожью тела.
Депрессивно-ипохондрическая реакция характеризуется полиморфизмом жалоб и их несоответствием данным объективного обследования. Чрезмерная фиксация пациента на состояние своего здоровья сопровождается постоянным контролем пульса, АД, ЭКГ и других признаков.
Лечение депрессии у больных с ИБС В настоящее время депрессию в легкой и средней степени тяжести успешно могут лечить кардиологи или врачи общей практики. Назначение неселективных трициклических антидепрессантов (амитриптилин, тизерцин) постинфарктным больным нежелательно вследствие их негативного влияния на сердечнососудистую систему. Их прием может сопровождаться соматотропными и поведенческими реакциями (сонливость, снижение уровня внимания, ухудшение памяти, нарушение мотивации движения), а также рефракторной тахикардией, ортостатической гипотонией (особенно у пожилых больных), удлинением интервалов Р-Q и ЭКГ.
Антидепрессанты нового поколения обладают селективностью, и в связи с этим они лишены вышеперечисленных побочных эффектов, характерных для трициклических антидепрессантов. В то же время по антидепрессивной эффективности они им не уступают, а по переносимости и безопасности превосходят. Что очень важно, препараты новой группы антидепрессантов оказывают не только антидепрессивное действие, но и устраняют чувство тревоги, в связи с чем они эффективны у больных сопутствующей тревожной симптоматики, панических атак, фобических синдромов.
При лечении депрессий у больных, перенесших инфаркт, следует придерживаться следующих основных принципов:
1) отдавать предпочтение антидепрессантам нового поколения с благоприятным кардиалъным профилем;
2) не превышать рекомендуемые суточные дозы антидепрессантов: циталопрам (ципрамил) — 10-20 мг/сут (обычная доза 20 мг/сут), миансерин (леривон) — 30-60 мг/сут, сертралин (золофт) — 25-200 мг/сут (обычная доза 100 мг/сут в 2 приема), ксанакс — 0,75 мг/сут в 3 приема, флуоксетин — 10-20 мг/сут однократно утром (обычная доза 20 мг/сут), флувоксамин (феварин) — 25—100 мг/сут (обычная доза 100 мг/сут), пароксетин (паксил) — 10-60 мг/сут (обычная доза 20 мг/сут), тианептин (коаксил) — 75 мг/сут в 3 приема (обычная доза 37,5 мг/сут), у больных старше 70 лет 50 мг/сут в 2 приема. Эти дозы являются терапевтическими при депрессиях легкой и средней тяжести и в большинстве случаев титрования дозы не требуется.
Антидепрессивный эффект нарастает постепенно и становится значимым к концу первых 2 нед. терапии. Желательно проинформировать об этом больного с тем, чтобы он не ожидал немедленного положительного действия после приема препарата. При недостаточной эффективности указанные выше дозы могут быть увеличены; 4) соблюдать определенную длительность курсового приема — не менее 1,5 мес. При выражении) депрессивных расстройствах длительность лечения может быть увеличена до 4-6 мес и более в завис и мости от состояния пациента. Для антидепрессантов нового поколения привыкание, а также синдром отмены нехарактерны. Эта особенность действия позволяет отменять их одномоментно, без предварительного снижения дозы, даже после дли тельного курса лечения.
Диспансеризация после инфаркта миокарда
Диагноз постинфарктного кардиосклероза устанавливается через 2 мес с момента возникновения ИМ. Именно в эти сроки заканчивается формирование рубцовой соединительной ткани в месте некроза сердечной мышцы. Пациенты, перенесшие ИМ, первый год должны наблюдаться у кардиолога в условиях кардиологического диспансера или поликлиники, желательно наблюдение и н последующие годы.
Частота наблюдений и обследование больных с ИМ на поликлиническом этапе реабилитации.
При первом посещении больного к врачу заполняется амбулаторная карта, составляется план ведения и лечения больного, перед выпиской на работу пишется выписной эпикриз и план диспансерного наблюдения.
В период амбулаторного лечения больной должен посещать врача один раз каждые 7-10 дней, вплоть до выписки на работу. Затем после 1-й, 2-й недели и в конце первого месяца работы. Далее 2 раза в месяц в первые полгода, в последующие полгода — ежемесячно. Второй год — один раз в квартал. При каждом посещении больного снимается ЭКГ.
Проба с физической нагрузкой (тредмил, ВЭМ, ЧИЭС) проводится после 3 месяцев развития ИМ (и некоторых клиниках у больных с неосложненным течением инфаркта в конце 1-го месяца лечении), затем перед выпиской на работу и/или при пи правлении на медико-социальную экспертизу. Далее не реже 1 раза в год.
ЭхоКГ: по приезде из кардиологического санатория, перед выпиской на работу и далее один раз в год с Q-образующим ИМ, при ФВ менее 35 или при дисфункции ЛЖ — I раз в 6 мес, холтеровское мониторирование ЭКГ: по приезде из санатория, перед выпиской на работу и направления на МСЭК, далее 1 раз в 6 месяцем. Общий анализ крови, мочи, глюкоза крови исследуются перед выпиской на работу и/или при отравлении на МСЭК, далее 1 раз в 6 мес в 1-й год, и последующем не реже 1 раза в год, ACT и АЛТ 1 раз в год (если принимает статины). Исследование липидного профиля: ОХ, ЛПНП, ЛПВП и ТГ через 3 мес после начала противосклеротической терапии, в последующем — каждые 6 мес. Другие анализы делаются по показаниям.
При необходимости возможно внеочередное посещение врача, в том числе консультации и по телефону.
Оптимальные сроки продолжительности пребывания на больничном листе больных с ИМ.
При ИМ без существенных осложнений и при стенокардии не выше I ФК средние сроки пребывания на больничном листе составляют до 2 мес. При инфаркте, протекающем без существенных осложнений — 2-3 месяца. При осложненном течении ИМ, независимо от его распространенности и при наличии коронарной недостаточности II ФК, срок пребывания на больничном листе составляет 3-4 мес. При рецидивирующем течении инфаркта или при наличии выраженной хронической коронарной недостаточности 3-4 ФК, СН 3-4 ФК, тяжелых нарушениях ритма и проводимости следует направлять больных (после 4 мес пребывания на больничном листе) на МСЭК для определения группы инвалидности.
Экспертиза трудоспособности. Если ИМ неосложненный (стенокардия ФК не более I и ХСН не более I стадии) — показано трудоустройство по КЭК. Если ИМ осложненный (стенокардия ФК не более II и ХСН не более II стадии) — также трудоустройство по рекомендации клинико-экспертной комиссии (КЭК), при потере квалификации направить на МСЭК для определения группы инвалидности. Если ИМ неосложненный (стенокардия ФК не более I и ХСН не более I стадии) — то лиц физического труда и/или большего объема производственной деятельности следует направлять на МСЭК для установления группы инвалидности. Если ИМ осложненный (стенокардия ФК более 1-2 и ХСН не более II стадии), то независимо от специальности больные также направляются на МСЭК для установления группы инвалидности.
Санаторно-курортное лечение. После перенесенного ИМ давностью более 1 года без приступов стенокардии или с редкими приступами напряжения без нарушения ритма и признаков СН не более 1 ФК возможно лечение как в местных кардиологических санаториях, так и на дальних климатических курортах (исключая горные). При более высоком ФК стенокардии и СН показано лечение только в местных санаториях.
Для получения более подробной информации пожалуйста пройдите по ссылке
Консультация по поводу лечения методами традиционной восточной медицины (точечный массаж, мануальная терапия, иглоукалывание, фитотерапия, даосская психотерапия и другие немедикаментозные методы лечения) проводится в Центральном районе Санкт-Петербурга (7-10 минут пешком от станции метро «Владимирская/Достоевская»), с 9.00 до 21.00, без обеда и выходных.
Уже давно известно, что наилучший эффект в лечении заболеваний достигается при сочетанном использовании «западных» и «восточных» подходов. Значительно уменьшаются сроки лечения, снижается вероятность рецидива заболевания. Поскольку «восточный» подход кроме техник направленных на лечение основного заболевания большое внимание уделяет «чистке» крови, лимфы, сосудов, путей пищеварения, мыслей и др. – зачастую это даже необходимое условие.
Консультация проводится бесплатно и ни к чему Вас не обязывает. На ней крайне желательны все данные Ваших лабораторных и инструментальных методов исследования за последние 3-5 лет. Потратив всего 30-40 минут Вашего времени вы узнаете об альтернативных методах лечения, узнаете как можно повысить эффективность уже назначенной терапии, и, самое главное, о том, как можно самостоятельно бороться с болезнью. Вы, возможно, удивитесь - как все будет логично построено, а понимание сути и причин – первый шаг к успешному решению проблемы!